近日,湖北大学生命科学学院病毒学和疫苗研究中心陈明周教授团队在《Nature Communications》上发表题为《AMFR-mediated Flavivirus NS2A ubiquitination subverts ER-phagy to augment viral pathogenicity》(E3连接酶AMFR介导的黄病毒NS2A蛋白泛素化操纵宿主内质网自噬增强病毒致病性)的研究论文。湖北大学生命科学学院陈明周教授、覃雅丽教授和武汉大学生命科学学院陈宇教授为共同通讯作者,湖北大学生命科学学院张林亮副教授和武汉大学王虹运博士为共同第一作者。

图1:文章首页
内质网是细胞中最大的膜结构细胞器,负责调节钙稳态、脂质代谢、蛋白质合成及运输,是维持真核细胞正常生理功能的重要组成部分。当机体遇到外界刺激(如钙离子失衡或病原体感染)时,未折叠或错误折叠的蛋白质会在内质网腔内积累,导致内质网的稳态受到破坏,从而触发内质网应激(ERS)。这时,未折叠蛋白质应答(UPR)被激活,启动一系列转录和翻译事件帮助恢复稳态。如果UPR的激活过度或持续过长,机体会启动内质网自噬,降解多余的内质网膜和有毒的蛋白质聚集体,从而动态调节内质网的数量和体积,维持稳态。
内质网自噬是一种由自噬受体介导的选择性自噬过程,通过调节内质网的碎片化并将其运送到溶酶体降解。目前已发现约有6种内质网自噬受体,如FAM134B、SEC62、ATL3、RTN3、CCPG1和TEX264等,这些受体分别位于片状或管状的内质网上,介导不同刺激下的自噬过程。许多病毒在侵入宿主后,会动态调控内膜系统(如内质网、线粒体、高尔基体等),形成病毒复制机器。尤其是正链RNA病毒(如黄病毒和冠状病毒),它们通过重塑内质网膜结构来形成复制细胞器,合成病毒蛋白,并在内质网上组装病毒粒子,完成生命周期。研究表明,病毒感染会引发持续的内质网应激,激活未折叠蛋白反应,破坏内质网稳态,促进病毒感染及细胞裂解。然而,作为维持内质网质量和容量稳态的重要过程,内质网自噬在病毒感染中的作用尚未得到充分研究。此外,病毒如何破坏内质网自噬以促进其致病性的机制仍然不明确。
本研究通过蛋白质组学分析发现,寨卡病毒(ZIKV)感染能够特异性降解内质网自噬的关键受体蛋白FAM134B。进一步的序列分析和生化实验表明,这一降解过程是由ZIKV的非结构蛋白NS2A介导的。进一步研究结果显示,定位在内质网的E3连接酶AMFR催化了病毒蛋白NS2A第56位赖氨酸的K48位多聚泛素化修饰。被泛素化的NS2A与FAM134B的N端结构域(NTD)相互作用,依靠AMFR来调节NS2A-FAM134B复合物的降解。团队还通过反向遗传学的方法成功构建了一种抑制内质网自噬能力丧失的重组ZIKV,并在脑类器官和动物模型中验证了寨卡病毒NS2A第56位赖氨酸对内质网自噬的抑制作用。这一作用不仅加重了寨卡感染导致的小头畸形症状,也对病毒引起的多脏器损伤和致病性十分重要。
值得注意的是,AMFR介导的ZIKV-NS2A泛素化以及与FAM134B的相互作用在其他黄病毒的NS2A中同样高度保守,包括登革热病毒、西尼罗河病毒和日本脑炎病毒等。因此,AMFR催化的黄病毒NS2A泛素化可能成为病毒致病性的重要因素。
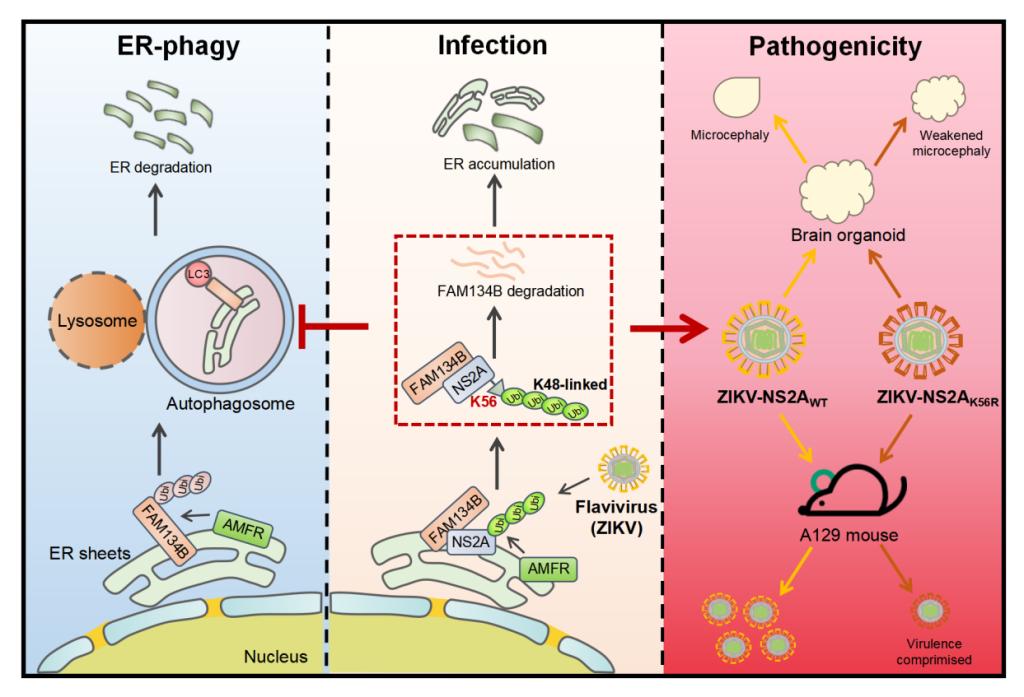
图2:黄病毒抑制内质网自噬增强病毒感染致病性研究模式图
上述研究发现黄病毒通过挟持宿主的E3泛素连接酶,特异性地靶向降解关键的内质网自噬受体,从而显著抑制内质网自噬进程。这一机制深入解析了病毒如何通过调控内质网自噬来增强其致病性的分子基础,揭示了病毒与宿主间复杂的相互作用,为病毒感染的机制提供了新视角。同时,这项研究为未来的抗病毒药物研发指明了方向,将病毒非结构蛋白作为新靶点的可能性,为开发更有效的治疗策略提供了理论依据,从而为应对黄病毒感染相关的公共健康挑战贡献力量,也为公共卫生领域的实际应用提供了新的思路。本研究得到了国家重点研发计划、国家自然科学基金委和武汉市自然科学基金等项目的资助。
陈明周教授负责的病毒学和疫苗研究团队,长期专注于医学分子病毒学研究。该团队的主要研究领域包括重要的人类和动物病毒,如人副流感病毒、呼吸道合胞病毒、寨卡病毒、肠道病毒71型、新冠病毒、埃博拉病毒、尼帕病毒和乙型肝炎病毒等。研究内容涵盖病毒的感染、复制与致病机制,深入解析病毒在宿主细胞中的复制、组装、释放过程以及病毒与宿主细胞的相互作用。团队结合结构生物学和生物信息学,以期发现和鉴定新的抗病毒治疗靶点。在筛选传统抗病毒小分子药物的同时,团队还开展了包括纳米抗体和mRNA疫苗在内的多种新型预防和治疗性抗病毒药物和疫苗研发。研究成果已发表在多个国际权威期刊上,包括《Cell Host & Microbe》《Nature Communications》《Cell Reports》《Cell Discovery》《Autophagy》《Protein & Cell》《PLoS Pathogens》和《Journal of Virology》。
论文链接:https://www.nature.com/articles/s41467-024-54010-w
(审稿:黄裕钊)